Quand un patient reçoit une perfusion de médicament biologique - comme l’infliximab, le rituximab ou le trastuzumab - il ne s’agit pas simplement d’administrer un traitement. C’est une procédure qui peut déclencher une réaction immédiate, parfois grave, même chez les patients en bonne santé. Ces réactions ne sont pas rares : entre 10 % et 40 % des patients les vivent, selon le type de molécule. Et si elles ne sont pas bien gérées, elles peuvent forcer à arrêter un traitement qui sauve la vie. Pourtant, la majorité de ces réactions peuvent être évitées - ou au moins maîtrisées - avec des protocoles clairs et des gestes précis.
Qu’est-ce qu’une réaction à une perfusion biologique ?
Les réactions aux perfusions biologiques ne sont pas toutes les mêmes. Elles se divisent en trois grandes catégories, selon leur mécanisme et leur délai d’apparition. Les réactions d’hypersensibilité immédiate surviennent dans les 1 à 2 heures suivant le début de la perfusion. Elles sont souvent dues à une réponse immunitaire, parfois liée à des anticorps IgE, mais pas toujours. Les symptômes ? Rougeurs, démangeaisons, urticaire, sensation de chaleur, ou encore essoufflement.
Les syndromes de libération de cytokines (CRS) apparaissent plus vite, souvent en quelques minutes. Le corps libère une vague de molécules inflammatoires (interleukine-6, TNF-alpha) qui provoquent de la fièvre, des frissons, une chute de la pression artérielle, et parfois des douleurs musculaires. Ce phénomène est fréquent avec le rituximab, surtout lors de la première perfusion.
Enfin, il y a les réactions retardées, qui se manifestent entre 24 et 72 heures après la perfusion. Elles sont moins graves, mais peuvent inclure des nausées, une fatigue intense, ou une éruption cutanée. Ces réactions sont souvent sous-estimées, car elles ne sont pas liées à la perfusion elle-même, mais à la réponse immunitaire ultérieure.
Comment classer la gravité d’une réaction ?
Pour agir au bon moment, il faut savoir évaluer la sévérité. Le système CTCAE v5.0, utilisé dans le monde entier, définit quatre niveaux :
- Grade 1 : symptômes légers - une légère rougeur, une légère fièvre. Aucune intervention médicale nécessaire.
- Grade 2 : symptômes modérés - urticaire, hypotension légère, essoufflement. Nécessite un arrêt de la perfusion et un traitement médical.
- Grade 3 : symptômes sévères - choc anaphylactique, bronchospasme, pression artérielle très basse. Exige une hospitalisation immédiate.
- Grade 4 : réaction potentiellement mortelle. Arrêt définitif du traitement. La reprise est déconseillée : 22 % des patients qui réessaient vivent une nouvelle réaction grave.
Il n’y a pas de place pour l’approximation. Même une légère rougeur peut être le premier signe d’une dégradation rapide. La clé ? Observer, écouter, et agir avant que ça ne dégénère.
Prévention : ce qui fonctionne vraiment
La prévention n’est pas une option. C’est une obligation. Et elle repose sur trois piliers : médicaments, hydratation, et rythme.
La prémédication standard est simple, mais efficace si elle est bien faite : 30 minutes avant la perfusion, on administre hydrocortisone 200 mg IV ou méthylprednisolone 125 mg IV. Cela réduit la formation d’anticorps anti-médicament de 47 % par rapport à un placebo. En parallèle, on donne diphenhydramine 50 mg IV - ou mieux encore, cétirizine 10 mg par voie orale, qui agit aussi bien mais cause 78 % moins de somnolence. Et pour calmer la fièvre, paracétamol 1 000 mg une heure avant.
L’hydratation est souvent ignorée, mais elle est cruciale. Une étude du NIH montre qu’infuser 100 mL/h de solution saline pendant les premières étapes, puis 250 mL/h à la fin, réduit le risque de syndrome de libération de cytokines de 63 %. Cela dilue les médicaments dans le sang, ralentit leur action, et stabilise la pression.
Le rythme des perfusions compte aussi. Pour les patients traités par adalimumab, une perfusion tous les 8 semaines au lieu de tous les 12 réduit de 32 % le risque de réaction. Pourquoi ? Parce que le système immunitaire n’a pas le temps de développer des anticorps contre le médicament.
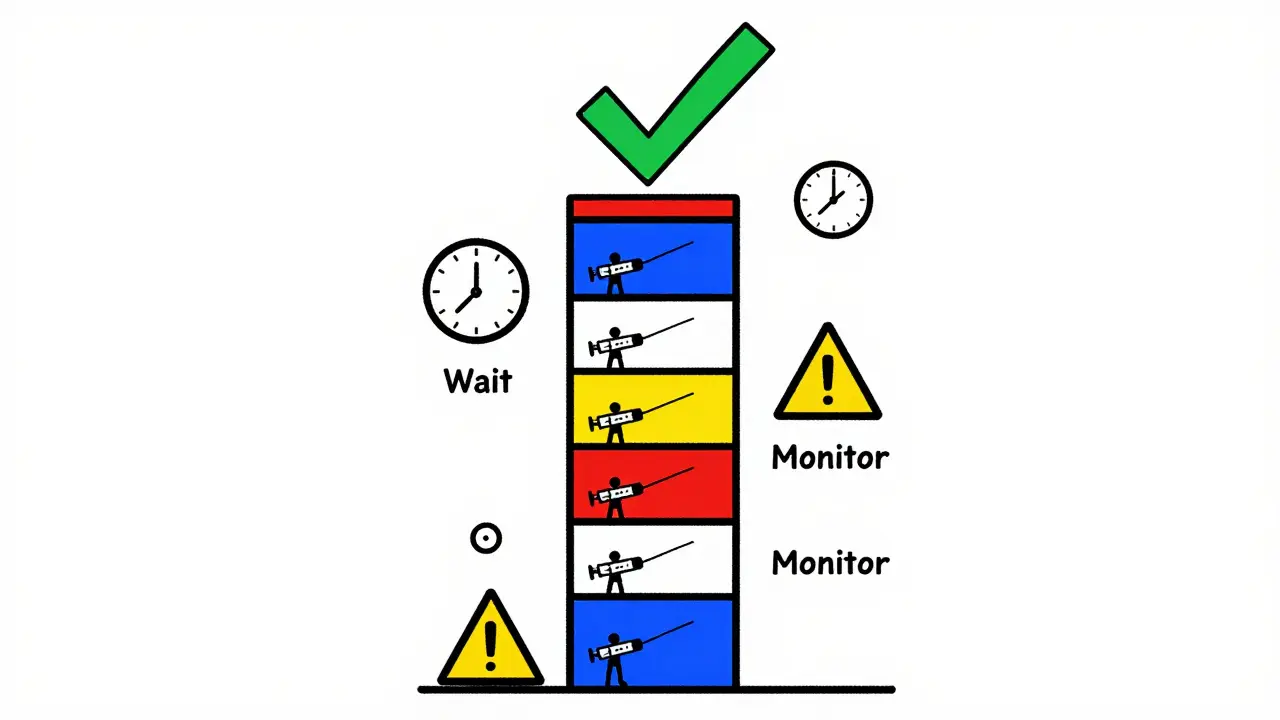
Le désensibilisation : quand on ne peut pas arrêter le traitement
Beaucoup de patients doivent continuer leur traitement, même après une réaction. C’est le cas dans les maladies auto-immunes comme la polyarthrite rhumatoïde, ou dans certains cancers. Arrêter, c’est risquer une rechute. Alors on désensibilise.
Le protocole le plus utilisé est le protocole en 12 étapes pour les perfusions intraveineuses. On commence avec 1 % de la dose totale, administrée à 0,1 mL/min. On augmente progressivement, en espacant les étapes de 15 à 30 minutes. À la fin, on donne la dose complète en 4 à 6 heures. Ce protocole réussit dans 97 % des cas pour le rituximab, 95 % pour le trastuzumab, et 89 % pour l’infliximab.
Il existe aussi un protocole en 7 étapes pour les injections sous-cutanées. Moins connu, mais tout aussi efficace. La clé ? Ne jamais sauter d’étape. Même si le patient va bien, on attend. La patience sauve des vies.
Le principal inconvénient ? Le temps. Une séance de désensibilisation prend entre 4 et 8 heures. Et 23 % des patients vivent une réaction pendant la procédure. Mais 92 % de ces réactions sont légères - et gérables sans arrêter le traitement.
Que faire en cas d’urgence ?
Si une réaction grave survient - essoufflement, chute de tension, gonflement de la gorge - on arrête la perfusion immédiatement. Pas de temps à perdre.
- On met le patient allongé, jambes surélevées pour améliorer la circulation.
- On administre adrénaline intramusculaire : 0,01 mg/kg, soit 0,3 à 0,5 mg chez l’adulte, dans la face externe de la cuisse. On peut répéter toutes les 3 à 5 minutes si nécessaire.
- Si la respiration est compromise, on utilise un nébuliseur d’adrénaline à 5 mg dans 3 mL de sérum physiologique. Les effets apparaissent en 2 à 5 minutes.
- On donne diphenhydramine 50 mg IV pour l’urticaire, et méthylprednisolone 125 mg IV pour réduire l’inflammation.
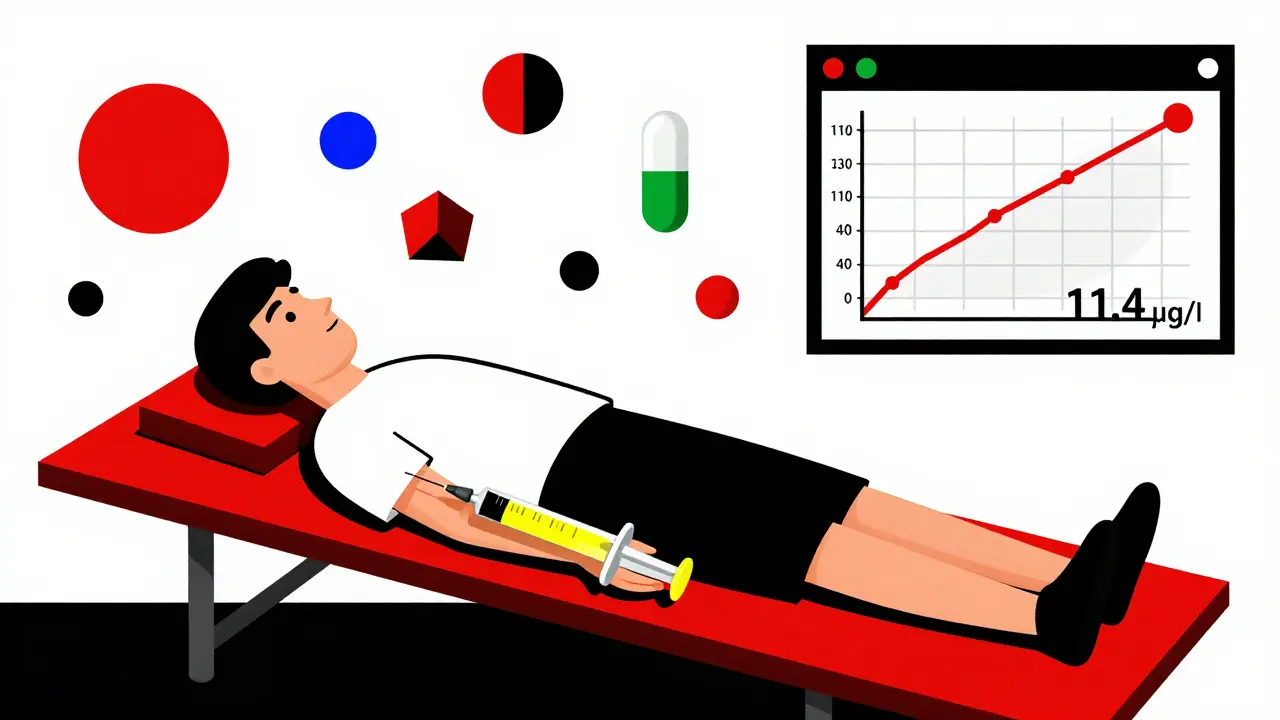
Et surtout : on mesure la tryptase sérique entre 30 et 120 minutes après la réaction. Si le taux dépasse 11,4 µg/L, et qu’il est supérieur de 20 % à la valeur de base plus 2 µg/L, c’est un diagnostic d’anaphylaxie confirmé. Ce test est obligatoire pour les réactions de grade 2 ou plus. Il permet de distinguer une réaction allergique d’une simple réaction inflammatoire.
Les erreurs à éviter absolument
Les erreurs sont souvent humaines, et elles sont coûteuses.
- Ne pas prémédiquer parce que « le patient n’a jamais eu de réaction ». Une première réaction peut être mortelle. Il n’y a pas de « première fois sans risque ».
- Utiliser des corticoïdes pour masquer les symptômes. Un médecin peut penser que la fièvre et la rougeur sont « normales » et continuer la perfusion. Mais selon une étude du JACI, 18,7 % des réactions anaphylactiques sont sous-estimées à cause des corticoïdes.
- Reprendre le traitement après une réaction de grade 4. La règle est claire : si le patient a eu un choc anaphylactique, on ne réessaie pas. Le risque de récidive est trop élevé.
- Ne pas documenter. Toute réaction doit être notée : heure, symptômes, traitement, tryptase. Cela permet de guider les prochaines perfusions.
Le futur : des outils plus intelligents
Les choses changent vite. En 2024, la FDA a approuvé le premier kit standardisé de désensibilisation, BioShield®, qui contient des dilutions prêtes à l’emploi et des cartes de protocole pour 12 médicaments. Plus besoin de préparer manuellement les solutions. Moins d’erreurs.
Un essai clinique du NIH, le DESERVE, teste un nouveau protocole en 8 étapes, avec une mesure en temps réel de l’interleukine-6. Résultat provisoire : 98,2 % de réussite. C’est une révolution.
Et bientôt, l’intelligence artificielle viendra en aide. L’algorithme BioReaction Score™, validé sur plus de 12 000 patients, prédit avec 87,4 % de précision qui va avoir une réaction. Il prend en compte : le taux d’IL-6 basal, un gène spécifique (HLA-DRA*0102), et même les antécédents d’allergie aux antibiotiques. Dans cinq ans, la perfusion ne sera plus une loterie. Ce sera un calcul.
Conclusion : la sécurité, c’est un processus, pas une chance
Les médicaments biologiques transforment la vie des patients. Mais leur administration n’est pas anodine. Une réaction n’est pas un accident. C’est un événement prévisible - et prévenable. Ce qui fait la différence, ce n’est pas le médicament. C’est la rigueur du protocole. La formation du personnel. La vigilance constante.
Il n’y a pas de « bonne » perfusion sans préparation. Il n’y a pas de « bon » traitement sans plan d’urgence. Et il n’y a pas de place pour la routine. Chaque perfusion est une nouvelle chance - et une nouvelle responsabilité.
Quelles sont les réactions les plus fréquentes aux perfusions biologiques ?
Les réactions les plus courantes sont les réactions d’hypersensibilité immédiate : rougeurs, démangeaisons, urticaire, sensation de chaleur. Les syndromes de libération de cytokines - fièvre, frissons, hypotension - sont fréquents lors de la première perfusion de médicaments comme le rituximab. Les réactions retardées (24 à 72 heures après) sont moins graves mais souvent négligées.
Faut-il toujours prémédiquer avant une perfusion biologique ?
Oui, pour tous les patients recevant un biologique pour la première fois, et souvent pour les suivantes. La prémédication standard - corticoïdes, antihistaminique, paracétamol - réduit de 30 à 50 % le risque de réaction. Même si le patient n’a jamais eu de réaction, la prémédication est recommandée par les sociétés savantes. Elle est une protection, pas une option.
Quand faut-il arrêter définitivement un traitement biologique ?
On arrête définitivement après une réaction de grade 4 - c’est-à-dire une réaction potentiellement mortelle, comme un choc anaphylactique ou un arrêt cardiaque. La reprise est déconseillée : 22 % des patients qui réessaient vivent une nouvelle réaction grave, parfois fatale. Les lignes directrices de l’ASCO et de la FDA sont claires : pas de reprise après un grade 4.
La désensibilisation fonctionne-t-elle pour tous les biologiques ?
Elle fonctionne très bien pour la plupart : 97 % pour le rituximab, 95 % pour le trastuzumab, 89 % pour l’infliximab. Mais elle est moins efficace avec les anti-IL-6 comme le tocilizumab, où le syndrome de libération de cytokines est plus difficile à contrôler. Dans ces cas, les taux d’échec peuvent atteindre 8,7 %. Il faut adapter le protocole et surveiller en temps réel.
Le test de tryptase est-il obligatoire après une réaction ?
Il n’est pas toujours obligatoire, mais il est fortement recommandé pour toute réaction de grade 2 ou plus. Le taux de tryptase s’élève pendant l’anaphylaxie. Si le taux dépasse 11,4 µg/L et qu’il est supérieur de 20 % à la valeur de base plus 2 µg/L, c’est un diagnostic d’anaphylaxie confirmé. Cela permet d’éviter les erreurs de diagnostic et de mieux préparer les prochaines perfusions.
Peut-on utiliser la cetirizine à la place de la diphenhydramine ?
Oui, et c’est souvent préférable. La cetirizine 10 mg par voie orale est aussi efficace que la diphenhydramine 50 mg IV pour bloquer les réactions allergiques, mais elle cause 78 % moins de somnolence. Cela permet au patient de rester alerte, de mieux communiquer ses symptômes, et réduit les risques de chute ou de confusion.
11 Commentaires
vincent PLUTA
Je viens de finir une perfusion de rituximab hier, et j’ai été impressionné par la rigueur du protocole. Prémédication, hydratation, rythme lent… tout était nickel. Même si j’ai eu une petite fièvre, ça s’est calmé en 20 minutes. Ce qui compte, c’est que le personnel soit formé et pas en mode automatique. Merci pour ce résumé ultra clair.
Clio Goudig
Encore un article qui fait peur pour rien. Tous ces protocoles, ces tests, ces doses… on dirait un manuel de l’armée. Et si on arrêtait de traiter les patients comme des bombes à retardement ?
Dominique Hodgson
La tryptase c’est de la merde en pratique. J’ai vu des gars avec un taux à 15 et qui allaient bien comme des bombes. Et les gens qui veulent un test pour chaque rougeur ? Trop de paperasse, pas assez de bon sens. La réaction c’est quand tu vois le patient qui se tient la gorge et qui pâlit. Pas un chiffre sur un écran.
Yseult Vrabel
OH MON DIEU JE VIENS DE LIRE CET ARTICLE ET JE SUIS EN LARMES. C’EST TELLEMENT BIEN FAIT. J’AI TRAVAILLE DANS UN HOPITAL PENDANT 12 ANS ET PERSONNE NE PARLAIT COMME ÇA. C’EST PAS JUSTE UN ARTICLE, C’EST UN MANIFESTE. LES INFIRMIERS DOIVENT LIRE ÇA. LES MÉDECINS DOIVENT L’IMPRIMER ET LE COLLER SUR LEUR TABLE. JE VEUX QUE TOUT LE MONDE VOIE ÇA. C’EST LA VIE OU LA MORT ET TU NE PEUX PAS FAIRE COMME SI T’ÉTAIS DANS UN FILM D’ACTION.
Bram VAN DEURZEN
Il est regrettable que cet article, bien que techniquement correct, néglige la dimension éthique de la désensibilisation systématique. L’obligation de prolonger un traitement à risque, même après une réaction modérée, constitue une forme de paternalisme médical qui instrumentalise la vulnérabilité du patient. La notion de consentement éclairé devrait primer sur la logique de performance thérapeutique.
Eveline Hemmerechts
On a tout prévu. On a tout mesuré. On a tout noté. Mais personne ne parle du patient qui pleure dans la salle d’attente parce qu’il a peur de mourir pendant la perfusion. On traite les chiffres, pas les gens. 😔
Dani Kappler
Je suis d’accord avec Clio… pourquoi on fait tout si compliqué ? Je me souviens quand j’étais en stage, on donnait juste un antihistaminique et on regardait. Et ça marchait. Maintenant, on a 12 étapes, des cartes, des algorithmes… c’est devenu un show. Et le patient ? Il est perdu.
Rachel Patterson
Le protocole BioShield® mentionné est effectivement une avancée majeure, mais il est crucial de souligner que son adoption reste limitée à environ 17 % des centres hospitaliers en France, en raison de contraintes budgétaires et de manque de formation. Il convient donc de ne pas surévaluer son impact actuel.
Elaine Vea Mea Duldulao
À tous ceux qui disent que c’est trop compliqué : vous avez raison. Mais c’est aussi la seule façon de sauver des vies. Chaque étape, chaque minute d’attente, chaque dose de corticoïde… c’est pour quelqu’un qui va rentrer chez lui demain. Vous pouvez être fatigué. Mais le patient, lui, il n’a pas le choix.
Alexandra Marie
Je suis infirmière en oncologie. J’ai vu des patients faire une réaction de grade 3… et revenir 3 semaines après pour une désensibilisation. Ils ont réussi. Ils pleuraient en sortant. On les a applaudis. Ce n’est pas un protocole. C’est de l’humain. Et oui, ça prend 6 heures. Mais ça vaut la peine.
andreas klucker
Interessant mais faut pas oublier que les biomarqueurs comme HLA-DRA*0102 sont rares dans les populations non-européennes. L’algorithme BioReaction Score™ a été validé sur 12000 patients mais 87 % sont d’origine caucasienne. C’est une biais majeur qui risque d’entrainer des erreurs dans les populations diversifiées. On parle de personnalisation mais on répète les mêmes erreurs du passé