Calculateur de probabilité d'embolie pulmonaire (Score de Wells)
Évaluation des critères de Wells
Cochez les critères correspondants à votre situation :
Points clés
- L'embole pulmonaire bloque la circulation sanguine dans les artères pulmonaires, augmentant la pression artérielle pulmonaire.
- Le cœur doit travailler plus fort pour compenser le manque d'oxygène, ce qui peut conduire à une insuffisance cardiaque droite.
- Les poumons subissent une ventilation‑perfusion déséquilibrée, provoquant dyspnée et hypoxémie.
- Le traitement combine anticoagulants, thrombolyse et suivi de la fonction cardiaque et pulmonaire.
- Une surveillance à long terme réduit le risque de syndrome post‑embolie.
Qu'est‑ce qu'un Embole pulmonaire obstruction d'une artère pulmonaire par un caillot sanguin (thrombus) provenant souvent des veines profondes des membres inférieurs ?
Lorsque le caillot se déloge et atteint les poumons, il crée un embole pulmonaire. Selon les dernières données de 2024, environ 600000 cas sont diagnostiqués chaque année en Europe. Le degré d'obstruction varie de micro‑embole (quelques petites branches) à embole massive (bloquant plus de 50% du flux pulmonaire). Cette variation influence directement la sévérité des symptômes et les complications cardiaques.
Comment l'embole agit‑il sur les poumons organes responsables des échanges gazeux entre le sang et l'air ambiant ?
Le blocage empêche le sang de traverser les capillaires alvéolaires. Le résultat est une mauvaise ventilation‑perfusion (V/Q) : certaines zones restent ventilées mais ne reçoivent pas de sang, d’autres reçoivent du sang sans être ventilées. Cette inégalité provoque une chute rapide de la PaO2 (pression partielle d'oxygène) et une élévation de la PaCO2. Cliniquement, le patient ressent une dyspnée soudaine, une tachypnée et parfois une douleur thoracique pleuritic. Sur le plan physiologique, l'hypoxémie entraîne la libération d'adrénaline, augmentant la fréquence cardiaque et la contractilité.
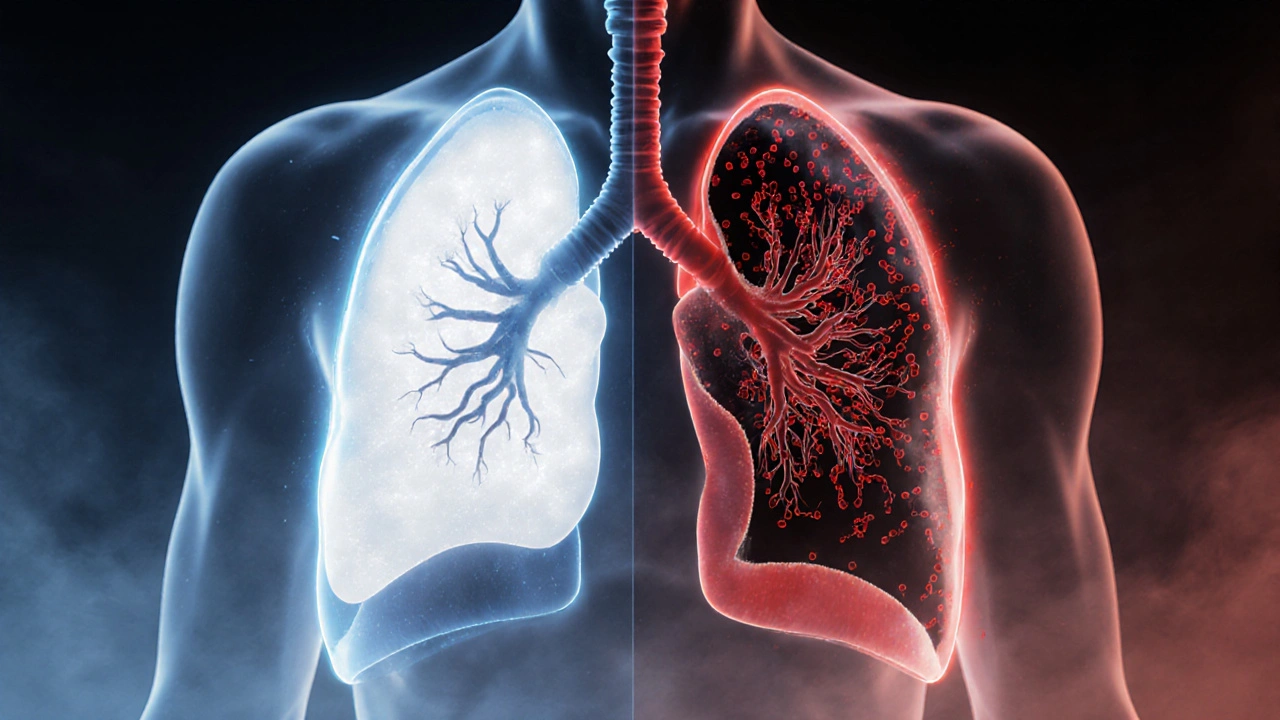
Impact sur le cœur organe musculaire qui assure la circulation du sang dans tout le corps : la pression artérielle pulmonaire
Le blocage pousse le sang contre une résistance accrue, ce qui élève la pression artérielle pulmonaire force exercée par le sang sur les parois des artères pulmonaires. Le ventricule droit, qui n'est pas habitué à de hautes pressions, voit sa charge de travail augmenter. À court terme, on observe une dilatation ventriculaire droite et une fonction systolique diminuée. Si la charge persiste, cela conduit à une insuffisance cardiaque droite, caractérisée par œdème périphérique, hépatomégalie et ascite. Les marqueurs biologiques comme le BNP (Brain Natriuretic Peptide) s’élèvent proportionnellement à la tension pulmonaire.
Signes cliniques différenciés : quand suspecter l'embole pulmonaire ?
Les symptômes pulmonaires (dyspnée, toux, hémoptysie) se combinent souvent avec des signes cardiaques (tachycardie, hypotension, cyanose). Un examen clinique doit relever :
- Une tachycardie >100bpm sans cause évidente.
- Un souffle systolique accentué au niveau du foyer tricuspidien, indicatif d'une surcharge du ventricule droit.
- Une hypoxémie (SpO₂ < 92% en air ambiant) qui ne répond pas immédiatement à l'oxygénothérapie.
Le score de Wells ou le modèle de Genève peut aider à quantifier la probabilité pré‑test et orienter la réalisation d’une scintigraphie pulmonaire ou d’un angioscanner.
Traitement : anticoagulants, thrombolyse et suivi
Le traitement repose sur trois piliers :
- Anticoagulants médicaments qui empêchent la formation de nouveaux caillots et limitent l'extension du caillot existant: héparine de bas poids moléculaire (HBPM) en phase aiguë, puis rivaroxaban ou apixaban pendant 3 à 6mois selon le risque de récidive.
- Thrombolyse administration d'agents fibrinolytiques (ex. alteplase) pour dissoudre le caillot en cas d'embole massive ou de détérioration hémodynamique. Les indications sont strictes : hypotension, choc ou signes de surcharge ventriculaire droite aiguë.
- Suivi cardiaque et pulmonaire: échocardiographie à 48h pour évaluer la fonction du ventricule droit, test de marche de 6minutes et, à plus long terme, tomodensitométrie de contrôle pour détecter le syndrome post‑embolie (CTEPH).
Les patients à haut risque bénéficient d’une anticoagulation prolongée (débutée par un régime de vitamine K antagoniste) et d’un programme de rééducation respiratoire.
Tableau comparatif : effets immédiats et à long terme sur le cœur et les poumons
| Organes | Effets immédiats | Conséquences à long terme | Signes cliniques |
|---|---|---|---|
| Poumons | Ventilation‑perfusion déséquilibrée, hypoxémie, douleur thoracique pleuritic | Hypertension pulmonaire chronique, syndrome post‑embolie (CTEPH) | Dyspnée, toux, hémoptysie, baisse du SpO₂ |
| Cœur | Augmentation de la pression artérielle pulmonaire, surcharge du ventricule droit | Insuffisance cardiaque droite, remodelage ventriculaire, élévation du BNP | Tachycardie, hypotension, souffle tricuspidien, œdème périphérique |
Prévention et mesures de suivi après un premier embolisme
Après la phase aiguë, la prévention de récidive repose sur l’identification des facteurs de risque : thrombose veineuse profonde, cancer actif, grossesse, immobilisation prolongée ou antécédents familiaux. Les stratégies comprennent:
- Portage d’un bas de contention gradué pour les patients à risque de TVP.
- Mobilisation précoce après chirurgie ou hospitalisation.
- Thérapie prophylactique anticoagulante chez les patients à haut risque (ex. LMWH post‑opératoire).
- Éducation du patient sur les signes d’alerte et l’importance de l’observance du traitement.
Un programme de suivi à 3, 6 et 12mois avec échocardiographie et évaluation fonctionnelle permet de détecter précocement le CTEPH et d’ajuster la prise en charge.
Questions fréquentes
Quel est le principal facteur de risque d'embole pulmonaire ?
La thrombose veineuse profonde (TVP) des membres inférieurs est la cause la plus fréquente, responsable de plus de 90% des embolies.
Comment distinguer une embolie légère d'une embolie massive ?
L'embole massive se manifeste par une hypotension (pression artérielle < 90mmHg), un choc ou une détresse respiratoire sévère, alors que l'embole légère ne provoque que dyspnée modérée et tachycardie sans chute de pression.
Les anticoagulants oraux sont-ils sûrs pendant la grossesse ?
Certains anticoagulants comme l’héparine de bas poids moléculaire sont compatibles avec la grossesse, tandis que les inhibiteurs directs du facteur Xa (rivaroxaban, apixaban) sont contre‑indiqués.
Quel suivi est recommandé après un embolie pour prévenir le syndrome post‑embolie ?
Une échocardiographie à 48h, puis à 3, 6 et 12mois, associée à un test de marche de 6minutes et, si symptômes persistants, une angio‑CT de contrôle pour dépister le CTEPH.
Peut‑on reprendre une activité physique normale après le traitement ?
Oui, la plupart des patients peuvent reprendre progressivement leurs activités après 2 à 4semaines, sous contrôle médical et avec un programme de rééducation adaptée.


10 Commentaires
Sean Verny
Ce calculateur de score de Wells révèle l'étrange danse entre la physiologie et la probabilité. Chaque critère, tel un coup de pinceau, colore le tableau clinique d'une nuance rougeâtre ou bleutée. La tachycardie, par exemple, est le premier éclat de lumière qui signale un malaise cardiaque imminent. L'hémoptysie, quant à elle, ajoute une teinte cramoisie, rappelant la fragilité de nos voies respiratoires. En combinant ces indices, on obtient une toile qui prédit, avec une assez bonne exactitude, la présence d'une embolie pulmonaire.
Joelle Lefort
Franchement, c'est trop stylé !
Fabien Gouyon
Ah, le score de Wells, ce petit maître du destin clinique, qui, dans son infinie sagesse, nous pousse à réfléchir à chaque battement d'un cœur haletant ; il nous rappelle que la médecine est autant une affaire de chiffres que de ressentis, n'est‑ce pas ?, 😅 il faut absolument considérer chaque point comme une goutte d'encre dans le grand livre de la vie ; la tachycardie > 100 bpm, c’est le premier signal d’alarme, une sorte de clignotement rouge qui attire notre attention ; l’hémoptysie, ce spectacle sanglant, vient parfois comme un rappel brutal que le corps ne garde pas ses secrets ; les antécédents de thrombose veineuse profonde, ils sont les vestiges d’un combat passé, une cicatrice que le corps porte ; le cancer actif, lui, ajoute une couche sombre, un nuage qui voile les réponses ; le développement soudain de dyspnée, c’est le souffle qui se fait rare, une brume qui descend ; enfin, l'absence d'autre explication, c’est le vide qui parle, le silence qui crie ; chaque critère est une pièce du puzzle, un fragment d'une mosaïque complexe qui nécessite patience et rigueur ; on ne doit pas sous‑estimer l'importance de ces éléments, car ils sont le socle d’un diagnostic précis ; le calculateur, avec ses boutons cliquetants, offre une interface moderne à une pratique ancestrale, un pont entre le passé et le futur ; il faut toutefois garder à l’esprit que l'outil n’est qu’un guide, pas le juge ultime ; l'expérience clinique reste le phare qui éclaire les décisions ; les erreurs de saisie, les petites fautes de frappe, peuvent fausser le score, il faut donc rester vigilant ; n’oublions pas que chaque patient est unique, et que les chiffres ne racontent qu’une partie de l’histoire ; en fin de compte, ce petit outil, humble mais puissant, nous aide à naviguer dans les eaux troubles de l’embolie pulmonaire, nous rappelant que la médecine est un art autant qu’une science.
Jean-Luc DELMESTRE
Le score de Wells, c'est un outil essentiel qui, lorsqu'il est utilisé correctement, permet aux cliniciens de rapidement identifier les patients à haut risque d'embolie pulmonaire et de prendre des décisions thérapeutiques cruciales pour améliorer les résultats cliniques et réduire la mortalité associée à cette condition potentiellement mortelle.
philippe DOREY
Il est moralement inacceptable que certains minimisent l'importance de ces critères, alors que chaque point peut sauver une vie. Prenons nos responsabilités !
Benoit Vlaminck
C’est exactement le genre d’outil qui rend notre travail plus sûr et plus efficace. Continuez comme ça !
Cédric Adam
Ce truc de calcul mystérieux ne fait que compliquer les choses, les vrais médecins savent déjà ce qui se passe sans ces gadgets inutiles. La France a toujours été forte, on n’a pas besoin d’aide étrangère pour ces conneries.
Eveline Erdei
Franchement, c’est du grand n'importe quoi, on perd du temps à cliquer sur des cases au lieu de traiter les patients ! Et puis, qui a écrit ce merdieux site ?
Anthony Fournier
Intéressant de voir comment les différents critères s'articulent entre eux ; cela montre bien la complexité du diagnostic et la nécessité d'une approche structurée ; je trouve que cet outil peut vraiment aider à clarifier les doutes, surtout dans les cas où les symptômes se chevauchent ; cependant, il faut garder à l'esprit que chaque patient reste unique.
Anne Vial
Oh, regarde, encore un tableau qui prétend tout savoir… 😒