Qu’est-ce qu’un générique autorisé ?
Un générique autorisé n’est pas un générique comme les autres. C’est la même pilule, le même spray, la même injection que le médicament de marque - mais sans le nom de la marque sur l’emballage. La Food and Drug Administration (FDA) des États-Unis le définit clairement : c’est un produit approuvé sous le dossier du médicament de marque, fabriqué avec les mêmes ingrédients actifs et inactifs, dans la même usine, parfois sur la même ligne de production. La seule différence ? Le nom sur la boîte. Pourtant, cette simplicité cache une stratégie complexe qui change la manière dont les patients accèdent aux médicaments après l’expiration des brevets.
Pourquoi les laboratoires créent-ils des génériques autorisés ?
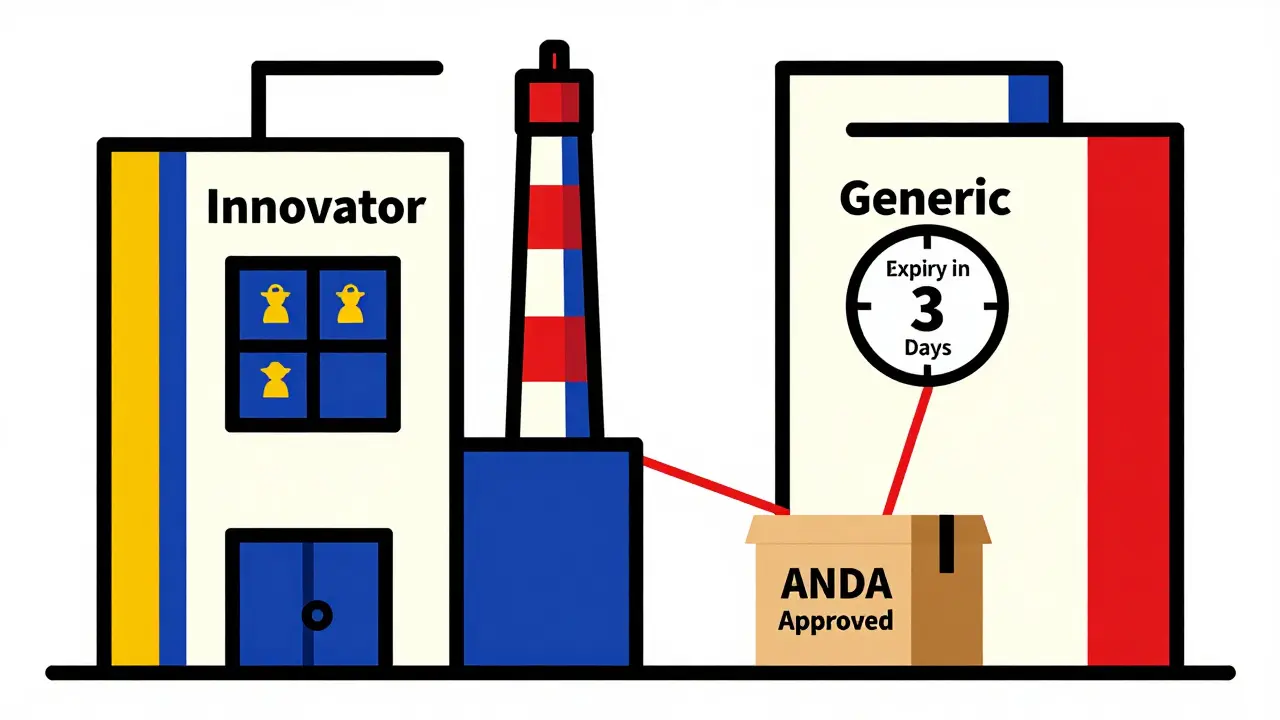
Quand un médicament de marque perd son brevet, tout le monde s’attend à ce que les prix chutent. Mais ce n’est pas toujours ce qui se passe. Les grands laboratoires, face à la concurrence des génériques traditionnels, ont développé une arme discrète : le générique autorisé. En lançant leur propre version générique - souvent quelques semaines avant ou pendant la période d’exclusivité d’un concurrent - ils conservent une part du marché. C’est une façon de protéger leurs revenus tout en offrant une alternative moins chère. Selon des analyses de Health Affairs, environ 70 % des génériques autorisés sont lancés pendant la période d’exclusivité de 180 jours accordée aux premiers génériques. Résultat ? Les prix n’ont pas toujours baissé autant qu’attendu. Dans certains cas, les réductions de prix ont été 15 % moins importantes que dans les marchés sans génériques autorisés.
Comment un générique autorisé diffère-t-il d’un générique classique ?
La différence est dans les détails. Un générique classique doit contenir le même ingrédient actif et être bioéquivalent - c’est-à-dire que le corps l’absorbe à peu près comme le médicament de marque. Mais il peut avoir des ingrédients inactifs différents : colorants, liants, conservateurs. Pour certains patients, ces différences sont critiques. Prenez la lévothyroxine, un traitement de l’hypothyroïdie. Même une petite variation dans les excipients peut faire chuter ou monter les taux d’hormones dans le sang. Beaucoup de patients ont rapporté une amélioration de leurs symptômes en passant d’un générique classique à un générique autorisé de lévothyroxine. Le même principe s’applique à des médicaments comme le warfarine (anticoagulant) ou le colchicine (pour la goutte). Le générique autorisé, lui, n’a aucun changement dans la formule. Pas un atome de plus, pas un atome de moins. C’est pour cela qu’il n’a pas besoin d’être réévalué par la FDA : il est déjà approuvé, sous le nom de la marque.
Quels médicaments ont une version générique autorisée ?
La FDA met à jour régulièrement sa liste officielle, la dernière version datant du 10 octobre 2025. Elle contient plus de 200 produits actifs. Voici quelques exemples concrets, largement utilisés :
- Colcrys (colchicine) → générique autorisé par Prasco Laboratories
- Concerta (méthylphénidate) → générique autorisé par Watson/Actavis
- Celebrex (célecoxib) → générique autorisé par Greenstone Pharmaceuticals
- Unithroid (lévothyroxine) → générique autorisé par Jerome Stevens Pharmaceuticals
- ProAir HFA (albuterol) → générique autorisé par Teva
- Jardiance (empagliflozin) → générique autorisé par Boehringer Ingelheim (ajouté en octobre 2025)
Comment les pharmaciens identifient-ils un générique autorisé ?
En pharmacie, les systèmes informatiques ne distinguent pas toujours clairement un générique autorisé d’un générique classique. Les deux apparaissent sous le nom générique du médicament. Mais les codes fabricant ou les numéros de lot peuvent révéler la différence. Un pharmacien expérimenté sait reconnaître les signes : une boîte avec un nom de marque connu comme fabricant, ou un nom de société qui correspond à un partenaire du laboratoire d’origine. Par exemple, si vous achetez un générique de ProAir HFA et que le fabricant est Teva, c’est probablement un générique autorisé. Si c’est une autre entreprise, c’est un générique traditionnel. Les patients doivent demander : « Est-ce que c’est la même formule que le médicament de marque ? » La réponse peut faire toute la différence, surtout pour les traitements à indice thérapeutique étroit.
Les avantages et les inconvénients pour les patients
Les avantages sont clairs : prix plus bas, composition exacte, pas de risque lié aux excipients. Pour les patients qui ont eu des réactions inattendues avec un générique classique, le générique autorisé est souvent une solution de secours. Des études cliniques montrent que certains patients retrouvent un équilibre hormonal ou une meilleure tolérance après le changement. Mais il y a un piège. Le générique autorisé n’est pas toujours disponible. Il peut être en rupture, ou simplement pas lancé dans votre pays. En Suisse, par exemple, les génériques autorisés sont rares, car le système de remboursement favorise les génériques traditionnels. De plus, l’emballage est différent - une pilule blanche au lieu d’une bleue, une boîte sans logo. Cela peut créer de la confusion. Un patient peut penser qu’il reçoit un produit de moindre qualité. C’est pourquoi les pharmaciens doivent expliquer clairement : « Même si elle est différente en apparence, cette pilule contient exactement la même substance que celle que vous preniez avant. »

Que faire si votre médicament n’a pas de générique autorisé ?
Si votre traitement n’a pas de version autorisée, vous avez deux options. La première : tester un générique classique, mais avec surveillance. Votre médecin peut vous demander de faire des analyses sanguines après le changement pour vérifier que le traitement reste efficace. La seconde : rester sur le médicament de marque, surtout si vous avez déjà eu des problèmes avec les génériques. Certains patients préfèrent payer plus pour éviter les risques. Ce n’est pas une question de luxe, mais de sécurité. Pour les traitements comme la lévothyroxine ou le warfarine, la stabilité est plus importante que l’économie.
Le futur des génériques autorisés
Les analystes prévoient une croissance de 5 à 7 % par an des nouveaux génériques autorisés jusqu’en 2027. Les laboratoires les voient comme un outil de gestion du marché, pas seulement comme une réponse à la concurrence. Mais les pouvoirs publics s’inquiètent. Le Bureau du Budget du Congrès américain a montré que les génériques autorisés ralentissent la baisse des prix. En 2022, les médicaments avec générique autorisé ont vu leurs prix baisser 12 % moins que ceux sans. Cela pose une question éthique : est-ce que cette stratégie profite aux patients, ou aux entreprises ? Pour l’instant, la FDA maintient que ces produits offrent un choix utile. Et pour certains patients, ce choix peut être une question de santé, voire de vie.
Comment vérifier si votre médicament a un générique autorisé ?
La meilleure source est la liste officielle de la FDA, mise à jour chaque mois. Vous pouvez la consulter sur le site de l’agence (en anglais). En France ou en Suisse, les pharmacies ou les médecins peuvent vous renseigner sur les disponibilités locales. Si vous avez un traitement récent, demandez à votre pharmacien : « Ce médicament a-t-il une version générique autorisée ? » Si la réponse est oui, demandez-la. Si la réponse est non, demandez pourquoi. Parfois, c’est une question de logistique. Parfois, c’est une décision stratégique. Mais vous avez le droit de savoir.
11 Commentaires
chantal asselin
C’est fou comment une simple différence d’excipients peut tout changer pour certains patients. J’ai une amie qui a passé 2 ans à chercher la bonne version de lévothyroxine avant de trouver le générique autorisé. Sa fatigue a disparu comme par magie. 🙌
Antoine Ramon
Je me demande si ce n’est pas là une forme de manipulation du système de santé. Les labos créent un générique pour garder le monopole… mais en le rendant plus sûr. Est-ce de l’ingénierie sociale ou une véritable avancée pour les patients ?
FRANCK BAERST
J’ai passé des heures à lire les fiches techniques après avoir eu des troubles digestifs avec un générique classique de warfarine. J’ai fini par trouver le générique autorisé de Pfizer et là c’était comme si j’avais retrouvé ma vie. Le corps reconnaît la formule exacte. Les excipients c’est comme changer de chaussures pour marcher sur du verre cassé. Et je suis pas le seul. Des études le prouvent mais personne n’en parle. Les pharmaciens doivent mieux informer. C’est pas juste une question de prix c’est une question de vie ou de mort pour certains. On parle de traitements à indice thérapeutique étroit. Une variation de 5 % peut faire basculer quelqu’un dans l’hémorragie ou le caillot. Et pourtant on continue à traiter ça comme un simple choix de budget.
Dany Eufrásio
Demandez toujours à votre pharmacien si c’est le générique autorisé. C’est simple. C’est vital.
Alexis Bongo
Je suis étonné que la FDA ne rende pas obligatoire un code couleur ou un logo distinctif pour ces génériques autorisés. C’est une lacune majeure. Les patients ne peuvent pas deviner. La transparence est un droit fondamental, pas un luxe.
Joelle Lefort
Je déteste quand les labos nous prennent pour des idiots. Ils nous vendent une pilule blanche en disant 'c’est pareil' mais ils gardent le vrai pour eux. C’est de la triche. 😡
Lois Baron
Attention à la liste de la FDA. Elle n’est pas toujours à jour. J’ai vérifié trois fois le générique de Jardiance et il n’était pas encore listé sur le site officiel en juillet. Les pharmaciens utilisent des bases obsolètes. C’est dangereux. 🚨
Sean Verny
Ce qui est fascinant, c’est que les génériques autorisés sont souvent fabriqués dans la même usine, sur la même ligne. C’est comme si vous achetiez la même tasse de café, mais sans le logo du café sur la tasse. Le goût est identique. Pourquoi alors se plaindre ? Parce que la peur du changement est plus forte que la logique. Et pourtant, les patients qui ont essayé disent : 'je ne retournerai jamais en arrière'.
Julien Turcot
Il est important de noter que les génériques autorisés ne sont pas une solution universelle. Dans certains pays, comme la Belgique ou la Suisse, les systèmes de remboursement ne les encouragent pas. Cela reflète une politique de santé différente, plus axée sur le coût global. Mais pour le patient souffrant, la qualité prime sur l’économie.
Nora van der Linden
J’ai pleuré quand j’ai trouvé mon générique autorisé de lévothyroxine. Après 3 ans de malaises, de palpitations, de dépression… J’ai demandé à mon pharmacien : 'c’est la même que celle que je prenais avant ?' Il a dit oui. J’ai pris la boîte, je l’ai serrée contre moi comme un bébé. Je me sens vivante pour la première fois depuis des années. 🥹💖
Eric Lamotte
Bien sûr que les laboratoires font ça pour faire du profit. Mais vous savez quoi ? Moi aussi je veux vivre. Si je dois payer 5 euros de plus pour une pilule qui ne me tue pas, je le ferai. Et je ne me sens pas coupable. La santé n’est pas un marché. C’est une survie.